Таблиця температур плавлення металів
У таблиці представлена температура плавлення металів t пл , їх температура кипіння t до при атмосферному тиску, щільність металів ρ при 25 ° С і теплопровідність λ при 27 ° С.
Температура плавлення металів, а також їх щільність і теплопровідність наведені в таблиці для наступних металів: актиній Ac, срібло Ag, алюміній Al, золото Au, барій Ba, берилий Be, вісмут Bi, кальцій Ca, кадмій Cd, кобальт Co, хром Cr, цезій Cs, мідь Cu, залізо Fe, галій Ga, гафній Hf, ртуть Hg, індій In, іридій Ir, калій K, літій Li, магній Mg, марганець Mn, молібден Mo, натрій Na, ніобій Nb, нікель Ni, нептуній Np , осмій Os, протактиний Pa, свинець Pb, паладій Pd, полоній Po, платина Pt, плутоній Pu, радій Ra, рубідій Pb, реній Re, родій Rh, рутеній Ru, сурма Sb, олово Sn, стронцій Sr, тантал Ta, технецій Tc, торій Th, титан Ti, талій Tl, уран U, ванадій V, вольфрам W, цинк Zn, цирконій Zr.
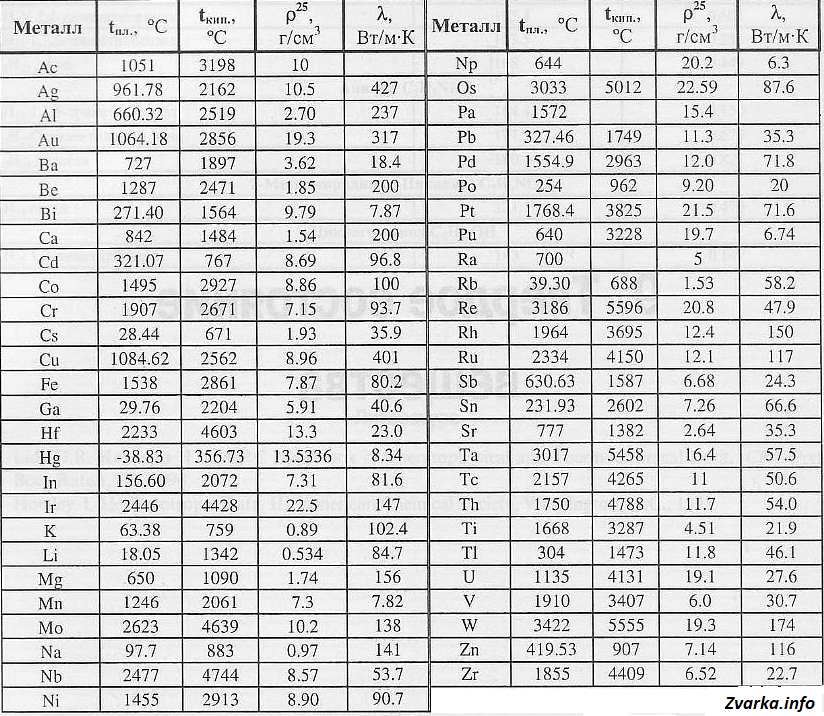
За даними таблиці видно, що температура плавлення металів змінюється в широкому діапазоні (від -38,83 ° С у ртуті до 3422 ° С у вольфраму). Низькою позитивною температурою плавлення мають такі метали, як літій (18,05 ° С), цезій (28,44 ° С), рубідій (39,3 ° С) і інші лужні метали.
Найбільш тугоплавкими є такі метали: гафній, іридій, молібден, ніобій, осмій, реній, рутеній, тантал, технецій, вольфрам. Температура плавлення цих металів вище 2000 ° С.
Наведемо приклади температури плавлення металів , широко використовуються в промисловості і в побуті:
- температура плавлення алюмінію 660,32 ° С;
- температура плавлення міді 1084,62 ° С;
- температура плавлення свинцю 327,46 ° С;
- температура плавлення золота 1064,18 ° С;
- температура плавлення олова 231,93 ° С;
- температура плавлення срібла 961,78 ° С;
- температура плавлення ртуті -38,83 ° С.
Максимальною температурою кипіння з металів, представлених в таблиці, має реній Re – вона становить 5596 ° С. Також високими температурами кипіння володіють метали, які відносяться до групи з високою температурою плавлення.
Щільність металів в таблиці знаходиться в діапазоні від 0,534 до 22,59 г / см 3, тобто найлегшим металом є літій, а найважчим металом осмій. Слід зазначити, що осмій має щільність більшу, ніж щільність урану і навіть плутонію при кімнатній температурі.
Теплопровідність металів в таблиці змінюється від 6,3 до 427 Вт / (м · град), таким чином найгірше проводить тепло такий метал, як нептуний, а кращим теплопроводящим металом є срібло.
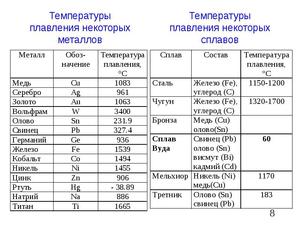
Температура плавлення заліза
Представлена таблиця значень температури плавлення сталі поширених марок. Розглянуто стали для виливків, конструкційні, жароміцні, вуглецеві та інші класи сталей.
Температура плавлення сталі знаходиться в діапазоні від 1350 до 1535 ° С. Стали в таблиці розташовані в порядку зростання їх температури плавлення.
Температура плавлення заліза – таблиця
| сталь | t пл , ° С | сталь | t пл , ° С |
| Сталі для виливків Х28Л і Х34Л | 1350 | Корозійно-стійке жароміцний 12Х18Н9Т | 1 425 |
| Сталь конструкційна 12Х18Н10Т | 1400 | Жароміцний високолегована 20Х23Н13 | 1440 |
| Жароміцний високолегована 20Х20Н14С2 | 1400 | Жароміцний високолегована 40Х10С2М | 1480 |
| Жароміцний високолегована 20Х25Н20С2 | 1400 | Сталь корозійностійка Х25С3Н (ЕІ261) | 1480 |
| Сталь конструкційна 12Х18Н10 | 1410 | Жароміцний високолегована 40Х9С2 (ЕСХ8) | 1480 |
| Корозійно-стійке жароміцний 12Х18Н9 | 1410 | Корозійно-стійкі звичайні 95Х18 … 15Х28 | 1500 |
| Сталь жароміцний Х20Н35 | 1410 | Корозійно-стійке жароміцний 15Х25Т (ЕІ439) | 1500 |
| Жароміцний високолегована 20Х23Н18 (ЕІ417) | 1415 | вуглецеві сталі | тисячі п’ятсот тридцять п’ять |
По матеріалам:
- Волков А. І., Жарський І. М. Великий хімічний довідник. – М: Радянська школа, 2005. – 608 с.
- Казанцев Є. І. Промислові печі. Довідник для розрахунків і проектування.
- Фізичні величини. Довідник. А. П. Бабічев, Н. А. Бабушкіна, А. М. Братковський і ін .; Під ред. І. С. Григор’єва, Е. З. Мейліхова. – М .: Вища школа, 1991. – 1232 с.
 Кожен метал і сплав має власний унікальний набір фізичних і хімічних властивостей, серед яких не останнє місце займає температура плавлення. Сам процес означає перехід тіла з одного агрегатного стану в інше, в даному випадку, з твердого кристалічного стану в рідкий. Щоб розплавити метал, необхідно підводити до нього тепло до досягнення температури плавлення. При ній він все ще може залишатися в твердому стані, але при подальшому впливі і підвищенні тепла метал починає плавитися. Якщо температуру знизити, тобто відвести частину тепла, елемент затвердіє.
Кожен метал і сплав має власний унікальний набір фізичних і хімічних властивостей, серед яких не останнє місце займає температура плавлення. Сам процес означає перехід тіла з одного агрегатного стану в інше, в даному випадку, з твердого кристалічного стану в рідкий. Щоб розплавити метал, необхідно підводити до нього тепло до досягнення температури плавлення. При ній він все ще може залишатися в твердому стані, але при подальшому впливі і підвищенні тепла метал починає плавитися. Якщо температуру знизити, тобто відвести частину тепла, елемент затвердіє.
Найвища температура плавлення серед металів належить вольфраму : вона становить 3422С про, найнижча – у ртуті: елемент плавиться вже при – 39С о. Визначити точне значення для сплавів, як правило, не представляє можливості: воно може значно коливатися в залежності від процентного співвідношення компонентів. Їх зазвичай записують у вигляді числового проміжку.
Як відбувається процес
 Плавлення всіх металів відбувається приблизно однаково – за допомогою зовнішнього або внутрішнього нагрівання. Перший здійснюється в термічній печі, для другого використовують резистивний нагрів при пропущенні електричного струму або індукційний нагрів в високочастотному електромагнітному полі. Обидва варіанти впливають на метал приблизно однаково.
Плавлення всіх металів відбувається приблизно однаково – за допомогою зовнішнього або внутрішнього нагрівання. Перший здійснюється в термічній печі, для другого використовують резистивний нагрів при пропущенні електричного струму або індукційний нагрів в високочастотному електромагнітному полі. Обидва варіанти впливають на метал приблизно однаково.
При збільшенні температури збільшується і амплітуда теплових коливань молекул , виникають структурні дефекти решітки, що виражаються в зростанні дислокацій, перескока атомів і інших порушеннях. Це супроводжується розривом міжатомних зв’язків і вимагає певної кількості енергії. В цей же час відбувається утворення квазі-рідкого шару на поверхні тіла. Період руйнування решітки та накопичення дефектів називається плавленням.
Поділ металів
Залежно від температури плавлення метали діляться на:
 Легкоплавкі: їм необхідно не більше 600С о. Це цинк, свинець, вісмут, олово.
Легкоплавкі: їм необхідно не більше 600С о. Це цинк, свинець, вісмут, олово.- Середньоплавкі: температура плавлення коливається від 600С про до 1600С о. Це золото, мідь, алюміній, магній, залізо, нікель і більша половина всіх елементів.
- Тугоплавкі: потрібна температура понад 1600С про, щоб зробити метал рідким. Сюди відносяться хром, вольфрам, молібден, титан.
Залежно від температури плавлення вибирають і плавильний апарат . Чим вище показник, тим міцніше він повинен бути. Дізнатися температуру потрібного вам елемента можна з таблиці.
Ще однією важливою величиною є температура кипіння. Це величина, при якій починається процес кипіння рідин, вона відповідає температурі насиченої пари, що утворюється над плоскою поверхнею киплячій рідини. Зазвичай вона майже в два рази більше, ніж температура плавлення.
Обидві величини прийнято приводити при нормальному тиску. Між собою вони прямопропорційні .
Основні фізичні властивості заліза
Температура плавлення хімічно чистого заліза становить 1539 о С. Технічно чисте залізо, отримане в результаті окисного рафінування, містить певну кількість розчиненого в металі кисню. З цієї причини температура його плавлення знижується до 1530 о С.
Температура плавлення сталі завжди нижча за температуру плавлення заліза в зв’язку з наявністю в ній домішок. Розчинені в залозі метали (Mn, Cr, Ni. Co, Mo, V і ін.) Знижують температуру плавлення металу на 1 – 3 ° С на 1% введеного елемента, а елементи з групи металлоидов (C, O, S, P і ін.) на 30 – 80 о С.
Протягом більшої частини загальної тривалості плавки температура плавлення металу змінюється головним чином в результаті зміни змісту вуглецю. При концентрації вуглецю 0,1 – 1,2%, яка характерна для доведення плавки в сталеплавильних агрегатах, температуру плавлення металу з достатньою для практичних цілей точністю можна оцінити з рівняння

Теплота плавлення заліза становить 15200 Дж / моль або 271,7 кДж / кг.
Температура кипіння заліза в виданнях останніх років наводиться рівній 2735 о С. Однак, опубліковані результати досліджень, згідно з якими температура кипіння заліза значно вище (до 3230 о С).
Теплота випаровування заліза становить 352,5 кДж / моль або 6300 кДж / кг.
Тиск насиченої пари заліза (P Fe , Па) можна оцінити за допомогою рівняння
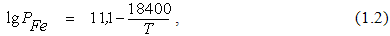
де Т – температура металу, К.
Результати розрахунку тиску насиченої пари заліза при різних температурах, а також змісту пилу в окислювальному газовій фазі над металом ( X , г / м 3) представлені в таблиці 1.1.
Таблиця 1.1 – Тиск насиченої пари заліза і запиленість газів при різних температурах
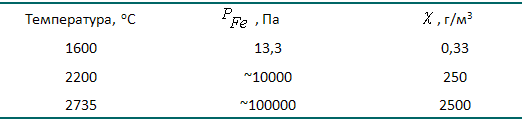
Згідно з існуючими санітарним нормам утримання пилу в газах, які викидаються в атмосферу, не повинно перевищувати 0,1 г / м 3. З даних таблиці 1.1 видно, що при 1600 о С запиленість газів над відкритою поверхнею металу вище допустимих значень. Тому обов’язково потрібно очищення газів від пилу, що складається в основному з оксидів заліза.
Динамічна в’язкість . Коефіцієнт динамічної в’язкості рідини ( 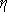 ) визначається зі співвідношення
) визначається зі співвідношення

де F – сила взаємодії двох рухомих шарів, Н;
S – площа дотику шарів, м 2;
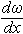 – градієнт швидкості шарів рідини по нормалі до напрямку потоку, с -1.
– градієнт швидкості шарів рідини по нормалі до напрямку потоку, с -1.
Динамічна в’язкість сплавів заліза зазвичай змінюється в межах 0,001 – 0,005 Па • с. Її величина залежить від температури і вмісту домішок, головним чином вуглецю. При перегрів металу над температурою плавлення вище 25 – 30 о С вплив температури не суттєво.
Кінематична в’язкість рідини являє собою швидкість передачі імпульсу в потоці одиничної маси. Її величина визначається з рівняння

де – щільність рідини, кг / м 3.
Величина динамічної в’язкості рідкого заліза близька до 6 • 10 -7 м 2 / с.
Щільність заліза при 1550 – 1650 ° С дорівнює 6700 – 6800 кг / м 3. При температурі кристалізації щільність рідкого металу близька до 6850 кг / м 3. Щільність твердого заліза при температурі кристалізації дорівнює 7450 кг / м 3, при кімнатній температурі – 7800 кг / м 3.
Зі звичайних домішок найбільший вплив на щільність розплавів заліза надають вуглець і кремній, знижуючи її. Тому звичайного складу рідкий чавун має щільність 6200 – 6400 кг / м 3, твердий при кімнатній температурі – 7000 – 7200 кг / м 3.
Щільність рідкої і твердої стали займає проміжне положення між густиною заліза і чавуну і становить відповідно 6500 – 6600 і 7500 – 7600 кг / м 3.
Питома теплоємність рідкого металу практично не залежить від температури. В оціночних розрахунках величину її можна приймати на рівні 0,88 кДж / (кг • К) для чавуну і 0,84 кДж / (кг • К) для сталі.
Поверхневий натяг заліза має максимальне значення при температурі близько 1550 о С. В області більш високих і низьких температур величина його зменшується. Це відрізняє залізо від більшості металів, для яких характерне зниження поверхневого натягу при підвищенні температури.
Поверхневий натяг рідких сплавів заліза істотно змінюється в залежності від хімічного складу і температури. Зазвичай воно змінюється в межах 1000 – 1800 мДж / м 2 (рисунок 1.1).
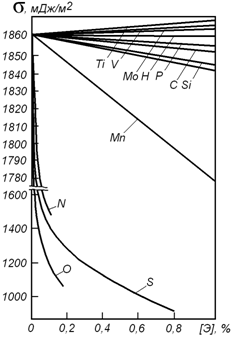
Малюнок 1.1 – Вплив домішок на величину поверхневого натягу сплавів заліза
Розчинність. Дуже обмежену розчинність в рідкому і твердому залозі мають лужні (Li, Na, K, Rb, Cs) і лужноземельні (Mg, Ca, Ba, Sr) метали. Крім того практично нерозчинними є Ag, Cd і Bi.
До числа металів, що мають необмежену розчинність в залозі, відносяться Mn, Ni, Co, Cu, Al, Sb, Ce і все рідкоземельні метали.
Обмеженою розчинністю в залозі володіють Cr, V, Mo, W, Ti, Zr, Pb, Sn, Pt та ін. Але при високих температурах всі метали цієї групи, крім Pb і Sn, розчиняються в розплавах заліза в необмежених кількостях.